Rangkuman IPA Kelas 10 BAB 5 Kurikulum Merdeka
Ringkasan / Rangkuman Materi IPA Kelas 10 BAB 5 "Struktur Atom – Keunggulan Nanomaterial" Kurikulum Merdeka - Tujuan pembelajaran adalah setelah mempelajari Bab 5 tentang HStruktur Atom – Keunggulan Nanomaterial, peserta didik diharapkan dapat :
1) mendeskripsikan pengertian dan pentingnya nanoteknologi,
2) menganalisis struktur atom dari unsurunsur,
3) menganalisis konfigurasi elektron menurut teori model atom Bohr,
4) menganalisis kecenderungan jari-jari atom dalam sifat keperiodikan unsur,
5) menerapkan konsep struktur atom pada bahasan nanomaterial.
Rangkuman Materi IPA Kelas 10 BAB 5 Kurikulum Merdeka
A. Pengertian dan Pentingnya Nanoteknologi
Kata nano berasal dari Bahasa Yunani yang artinya kerdil. Ukurannya adalah satu perseribu juta atau satu persemilyar. Jika dibandingkan terhadap ukuran meter maka satu nanometer (nm) sama dengan 10-9 m. Ukuran nano ini digunakan pada rekayasa teknologi sehingga dikenal dengan istilah nanoteknologi. Istilah ini muncul pada tahun 1974 yaitu saat Norio Taniguchi menyatakan bahwa material dapat dikontrol dan direkayasa hingga ukurannya lebih kecil dari ukuran mikrometer.
Ukuran nanopartikel memberikan sifat fisika dan sifat kimia baru. anosilika dapat bersifat nanofiller ketimbang silika yang tidak berukuran nano. Nanosilika dapat mengisi rongga-rongga kosong, contohnya dalam batubata sehingga mencegah pelapukan dan tidak kedap air.
B. Struktur Atom
Bagian atom merupakan partikel penyusun atom atau partikel subatom. Atom memiliki bagian inti atom yang disebut nukleus sebagai pusat atom. Inti atom ini menentukan massa atom. Inti atom ditempati oleh partikel atom yaitu proton (partikel atom bermuatan positif) dan neutron (partikel atom tidak bermuatan listrik). Adapun partikel atom bermuatan negatif menempati bagian di luar nukleus.
Partikel Penyusun Atom
Nomor massa menyatakan jumlah proton dan neutron sedangkan nomor atom menyatakan jumlah elektron. Dalam sebuah atom yang netral jumlah elektronnya sama dengan jumlah proton. Atom netral artinya atom tersebut tidak membentuk ion yaitu tidak melepas atau menangkap elektron pada kulit terluarnya.
Hubungan Lambang Unsur terhadap Partikel Penyusun Atom
C. Konfigurasi Elektron
Pada bab ini dibahas singkat dua teori model atom yang mendasari konfigurasi elektron yaitu teori model atom Niels Bohr dan mekanika kuantum. Persamaan kedua teori ini adalah menjelaskan posisi dan susunan elektron pada suatu lokasi di luar nukleus.
Bohr dan Burry secara bersamaan mengusulkan aturan konfigurasi elektron pada kulit atom, yaitu: (1) Elektron menempati kulit atom dimulai dari kulit yang paling dekat nukleus yaitu kulit K, (2) Jumlah maksimal elektron yang menempati tiap kulit mengikuti aturan 2n2 (n adalah nomor kulit), dan (3) Pada kulit terluar tidak dapat memiliki lebih dari 8 elektron dan kulit terluar sebelumnya tidak dapat memiliki lebih dari 18 elektron. Hal ini akan mengacu pada aturan oktet saat unsur-unsur bergabung membentuk senyawa. Adapun jumlah elektron pada kulit terluar disebut elektron valensi.
Konfigurasi elektron teori model atom Bohr
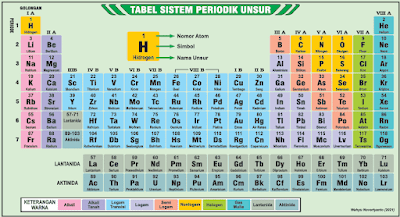
Mendeskripsikan Bagian Tabel Periodik Modern
Tabel periodik unsur yang Kalian kenal saat ini adalah sistem periodik modern atau dikenal dengan sistem periodik bentuk panjang yang dicetuskan oleh Henry G Moseley.
Tampilan tabel periodik bentuk panjang terdiri dari golongan dan periode. Dalam tabel periodik modern, atom dengan konfigurasi elektron yang serupa ditempatkan dalam satu kolom yang sama. Kolom ini dinamakan golongan yang dibaca dari atas ke bawah.
Golongan menyatakan jumlah elektron kulit terluar (elektron valensi) suatu atom dari unsur tersebut. Sedangkan periode merupakan deretan unsur-unsur yang disusun berdasarkan peningkatan nomor atom berurutan dari kiri ke kanan. Periode mendeskripsikan jumlah kulit atom yang dimiliki oleh atom unsur tersebut.
Tabel periodik bentuk panjang terdiri dari 18 golongan dan 7 periode yang diuraikan sebagai berikut.
1. Bagian Horizontal
a. Terdiri dari 7 baris horizontal disebut periode. Unsur-unsur pada periode disusun berdasarkan urutan nomor atom.
b. Periode ke-1 adalah periode terpendek yaitu terdiri dari 2 unsur “H” dan “He”.
c. Periode ke-2 dan ke-3 masing-masing memiliki 8 unsur.
d. Periode ke-4 dan ke-5 masing-masing memiliki 18 unsur.
e. Periode ke-6 memiliki 32 unsur. Ke-15 unsur diantaranya merupakan deret Lantanida atau logam tanah jarang (nomor atom 57-71).
f. Periode ke-7 terdiri dari unsur-unsur lainnya yang jumlahnya masih terus bertambah. Ke-15 unsur diantaranya merupakan unsur-unsur deret aktinida (nomor atom 89-103).
2. Bagian Vertikal
a. Kolom yang vertikal disebut golongan.
b. Ada 18 golongan.
c. Golongan dibagi menjadi 2 yaitu golongan utama (A) dan golongan transisi (B).
d. Golongan utama terdiri dari golongan I A hingga VIII A (golongan 1 A hingga III A adalah unsur logam sedangkan golongan IV A hingga VIII A adalah nonlogam).
e. Unsur B, Si, Ge, As, Sb, Te, Po, dan At adalah unsur-unsur semilogam atau metaloid.
f. Golongan transisi terdiri dari golongan I B hingga VIII B yaitu unsurunsur logam transisi.
g. Golongan lantanida dan aktinida juga dikelompokkan sebagai unsurunsur logam transisi.
D. Jari-jari Atom sebagai Sifat Keperiodikan Unsur
Bagaimana cara menghitung jari-jari atom? terdapat simbol “r” yaitu jari-jari dan “d” merupakan diameter. Adapun jari-jari atom dinyatakan dalam satuan Angstrom (Å). Satu Å = 100 pm (pikometer). Satu pm besarnya sama dengan 10-12 m. Ukuran jari-jari atom berkisar 30 - 300 pm.
E. Konsep Struktur Atom pada Bahasan Nanomaterial
Nanomaterial adalah salah satu aplikasi nanoteknologi. Sifat material sangat dipengaruhi oleh ukuran partikel yaitu atom maupun molekul penyusunnya. Material berukuran nano pada batasan 1-100 nm memiliki sifat antara lain titik lebur, konduktivitas listrik, permeabilitas magnetik, warna, optis, dan reaktivitas kimia yang unik dan berbeda dibandingkan material pada ukuran makroskopik.
Bagaimana konsep pembentukan material menjadi berukuran nano? Sintesis nanomaterial antara lain dapat dilakukan dengan metode (1) top-down yaitu sintesis secara fisika. Pada metode ini partikel besar dipecah menjadi partikel berukuran nanometer (2) bottom-up yaitu proses sintesis nanopartikel secara kimia dengan melibatkan reaksi kimia dari sejumlah material awal sehingga dihasilkan material lain yang berukuran nanometer. Konsep perubahan sifat material pada ukuran nano didasari oleh dua aspek yaitu (1) ukuran material (2) luas permukaan material.
Untuk Rangkuman / Ringkasan Materi Mapel IPA Kelas 10 Semester 1 dan 2 Kurikulum Merdeka BAB lainnya dapat dilihat secara lengkap dengan cara klik gambar berikut :
Demikian informasi tentang Rangkuman IPA Kelas 10 BAB 5 Kurikulum Merdeka yang bisa Sinau-Thewe.com bagikan, semoga ada manfaat didalamnya dan terima kasih.






Post a Comment for "Rangkuman IPA Kelas 10 BAB 5 Kurikulum Merdeka"